STEMI, obwohl keine ST-Hebungen
Die ESC-STEMI Leitlinien sprechen explizit eine wichtige Konstellation an: klinisch Zeichen einer anhaltenden Ischämie, im EKG aber keine signifikante Hebungen. Hier gilt, was jeder Arzt wissen be”herz”igen sollte: Nicht Troponin-Labor, nicht EKG – die Anamnese und Untersuchung des Patienten sind die wichtigsten Faktoren in der Diagnostik.
In addition, there is a concern that some patients with acute occlusion of a coronary artery and ongoing MI, such as those with an occluded circumflex coronary artery, acute occlusion of a vein graft, or left main disease, may present without ST-segment elevation and be denied reperfusion therapy, resulting in a larger infarction and worse outcomes. Extending the standard 12-lead ECG with V7–V9 leads may identify some of these patients. In any case, suspicion of ongoing myocardial ischaemia is an indication for a primary PCI strategy even in patients without diagnostic ST-segment Elevation.
2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC)
Klappenprothese Normalbefund (Beispiel)
Linker Ventrikel und systolische LV-Funktion: Keine Dilatation, normale LV-Funktion. Leichtgradige Hypertrophie.
Linker Vorhof und diastolische LV-Funktion: Keine Dilatation, keine diastolische Funktionsstörung
Aortenklappe: Bioprothese mit Stent Carpentier Edwards Perimount 27mm. Freie Bewegung der Segel, keine Auflagerungen oder Verkalkungen, Stent ohne Unterbrechung der Integrität und ohne pathologische Bewegung. Keine Stenose ( KÖF 2,0 cm2, Norm nach Hersteller min 1,7 cm2), keine Insuffizienz, kein paravalvuläres Leck.
Rechtes Herz: gute RV-Funktion, keine pulmonale Hypertonie.
Aorta ascendens: Keine Ektasie
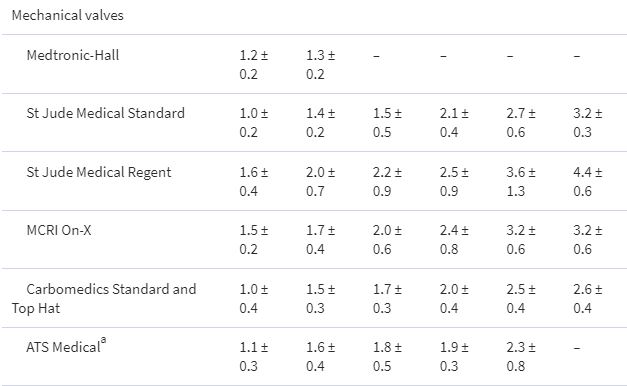
Referenzwerte der effektiven Öffnungsfläche von Prothesen
Hypertrophie-Schweregrade
Wanddicke (m/w)
normal bis 10/9mm
leichtgradig bis 13/12mm
mittelgradig bis 16/15mm
hochgradig darüber
Masse nach Linearmethode (m/w)
normal bis 115/95 g/m2
leichtgradig bis 131/108 g/m2
mittelgradig bis 148/121 g/m2
hochgradig darüber
Lang R, Badano L, Mor-Avi V, Afilalo J, Armstrong A, Ernande L, Flachskampf F, Foster E, Goldstein S, Kuznetsova T, Lancellotti P, Muraru D, Picard M, Rietzschel E, Rudski L, Spencer K, Tsang W and Voigt J-U (2015) Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Journal of the American Society of Echocardiography : official publication of the American Society of Echocardiography 1: 1-39.e14.
RV-fokusierte Anlotung
(1) Um zur RV-fokusierten Anlotung zu gelangen, wird die Sonde vom 4-Kammerblick aus unter Beibehaltung der Position des Apex vorsichtig im Uhrzeigersinn rotiert, dadurch wird die Fläche des RV größer. Dabei darf man nicht in den 5-Kammerblick geraten.
(2) In manchen Fällen ist es notwendig, die Sonde nach rechts zu kippen oder etwas nach medial zu gleiten.
(3) Die Anlotung wird verwendet in folgenden Fällen
1) lineare Messungen und Flächenmessungen des RV
2) TAPSE
3) Geschwindigkeitsmessungen
4) RV-Strainmessungen
Fortgeschrittene Herzinsuffizienz
Definition: persistierende Symptome NYHA III oder IV trotz optimaler Therapie, EF unter 30 (alternativ RV-Funktionstörung, nicht behandelbarer Klappendefekt, hohes BNP bei distolischer Funktionstörung), häufige Überwässerung, häufige low-output-Symptome, 6MWR unter 300m, max Sauerstoffkapazität unter 12 ml/kg/min, kardiale Kachexie, extrakardiale Organdysfunktion (Hepatopathie oder Niereninsufizienz)
Prognose 1-Jahres-Mortalität 25-75%.
Zunehmende Prävalenz. Immer mehr HF-Patienten, Alter zunehmend, bessere Behandlung, abnemende Mortalität.
Klassifizierung der Patienten mit potentieller Indikation für MCS (mechanische Kreislaufunterstützung) nach INTERMACS ( Interagency Registry for Mechanically Assisted Circulatory Support):
– 1 kardiogener Schock
– 2 progressive Verschlechterung
– 3 stabil unter Inotropica
– 4 häufige Dekompensation
– 5 NYHA IV Aber In Ruhe stabil, keine Aktivität möglich
– 6 Unter Aktivität sehr rasche Ermüdbarkeit
– 7 Beschwerden bei geringer Belastung (NYHA III)
Vorgehen: Ein Patient mit INTERMACS 1-4 erhält kurzzeitige Kreislaufunterstützung (Bridge zu Liste, Entscheidung, Transplantation, Erholung; IIa ) . Im Verlauf wird der Patient , wenn es zu keiner Erholung gekommen ist und keine Kontraindikation vorliegen für die Transplantation gelistet (I). Wenn nicht reversible Kontraindikationen vorliegen, erhält der Patient ein LVAD-DT (dauerhaftes LV-Assist-Device; IIa ), wenn reversible Kontraindikationen vorliegen ein LVAD-BTC (Assisst-Device bis zur Listung; IIa). Bei INTERMACS 5-7 erfolgt die Listung nur bei hohem Risiko (I), in allen anderen Fällen erfolgt ein engmaschiges Follow-up.
Zuweisung zu HF-Zentrum: NYHA III- und IV Patienten sollten einem Zentrum für fortgeschrittene Herzinsuffizienz zugeführt werden, wenn OMT und CRT zu keiner Besserung führen. NYHA II-Patienten sollten zugeführt werden , wenn eines der folgenden Kriterien zutrifft:
– 2 Einweisungen in 12 Monaten,
– früherer Inotropica-Bedarf,
– Intoleranz von Betablocker, ACE-Hemmer oder ARNI,
– EF unter 20%,
– Verschlechterung von RV-Funktion, Nierenfunktion oder Leberfunktion,
– Ventrikuläre Arrythmien,
– ICD-Schockabgabe,
– SBP unter 90 mmHG,
– Zeichen von peripherer Hypoperfusion.
Diese Kriterien sollten spätestens alle 6 Monate revaluiert werden. Ausgenommen sind Patienten mit eingeschränkter Lebenserwartung oder schlechter Lebensqualität.
Angiotensin-Rezeptor-Neprilysin-Inhibitor
Wirkstoffe: Sacubitril/Valsartan.
Handelsname Entresto
Sacubitril. Hemmt Neprilysin. Dieses Enzym deaktiviert vasoaktive Peptide wie ANP,BNP,CNP, die bei Herzinsufizienz positive Eigenschaften haben: Vasodilatation, Diurese, Verminderung von Aldostronsekretion, Remoddeling, Hypertrophie, Symptathicusaktivierung.
Wirkung: Verbesserung der Symptome, Verminderung der Hospitalisierung und Mortalität. Die Wirkung setzt nach einigen Wochen ein.
Indikation: HFrEF als Ersatz von ACE-Hemmer, wenn unter diesen die Symptomaik nicht ausreichend verbessert wird. Nur bei stabilen Patienten.
beidseitige Nierenarterienstenose ist KI
Schwangerschaft und Stillperiode ist KI
Allergie ist KI
Niereninsuffizienz: GFR bis 30 ml/min kann akzeptiert werden. Möglichst beteiligte Medikamente (NSAR) stoppen.
Hypotonie: kann bei asymptomatischen Pat. toleriert werden. Symptome Übelkeit, leichter Kopfschmerz, ggf. Vasodilatatoren reduzieren, bei Pat. ohne Überwässerung Diuretika reduzieren,
ACE-Hemmer: Min 36 h vorher absetzen, ansonsten drohen Angioödeme.
Hyperkaliämie: Cave bei K-sparenden Diuretika (Triamteren und Amilorid), NSAR . Bei einem Anstieg trotz aller möglichen Gegenmaßnahmen, kann die Dosis zunächst halbiert werden. Bei einem K über 5,5 sollte das Medikament abgesetzt und im Verlauf wieder durch ARB ersetzt werden.
Dosierung: Zu Beginn 49/51 mg 2 x täglich, frühestens nach 2 Wochen verdoppeln.
Reduzierte Dosis: Pat. mit SBP unter 110 mmHG, GFR unter 60 ml/min, Pat. ohne vorherigen ACE-Hemmer.
Blutkontrolle: 2 Wochen (NW, Kalium, bb) und 2 Wochen nach Verdopplung, dann alle 4 Monate.
Husten: es sollte erst genau differenziert werden, ob der Husten durch das Medikament, oder etwa durch Pleuraergüsse oder bronchial bedingt ist. Medikamentöser Husten verschwindet, wenn das Medikament pausiert wird. In diesem Fall sollte ein Angiotensin-I-Rezeptor-Blocker verwendet werden.
Dokumentation von Nebenwirkungen. Pat sollte angeleitet werden.
Aspekte zu SGLT2-Inhibitoren
Wirkstoffe und Handelsnamen: Empagliflozin (Jardiance), Dapagloflozin (Forxiga)
Wirkweise: Hemmt den Na-Glucose-Co-Transporter im prox. Tubulus
Indikation. SGLT2-Inhibitoren haben Empfehlungsklasse I mit Evienzgrad I bei allen Patienten mit HFrEF, unabhängig von Diabetes mellitus.
Hypoglykämie. Hypoglykämierisiko im Zusammenhang mit anderen Antidiabetika. Ggf. müssen andere Anti-Diabetika angepasst werden.
Risiko der Ketoazidose bei Pat. mit Diabetes mellitus Typ 1
Verstärkung der diuretischen Wirkung anderer Diuretika mit Gefahr des Nierenversagens
Nierenfunktion. SGLT2-Inhibitoren gelten also nierenprotektiv. Lediglich bei sehr eingeschränkter Funktion sind sie kontraindiziert. Die Nierenwerte sollten vor Erstgabe bekannt sein, und sollten im Verlauf regelmäßig kontrolliert werden. Bei einer GFR unter 20ml besteht eine Kontraindikation.
Hypotonie kann durch die diuretische Wirkung entstehen. Bei einem, Blutdruck unter 95mmHG sollte das Medikament abgesetzt werden.
Glucosurie mit Gefahr von Pilzinfektion im Urogenitalbereich. Bei Nichtdiabetikern ist zu beachten, dass die Glucosurie keinen pathologischen Wert hat.
Dosierung. Start- und Erhaltungsdosis sind 10mg per os.
Allergien gegen SGLT2-Inhibitoren gelten als Kontraindikation.
Wirkungsbeginn. Nach 4 Wochen.
Defibrillator bei HFrEF
Häufig ist der Tod bei Patienten mit Herzinsuffizienz und milden Symptomen plötzlich und unerwartet. Viele dieser Herztode sind durch rhythmologische Ereignisse wie ventrikuläre Rhythmus-Störungen, Bradikardie oder Asystolie bedingt, andere durch vaskuläre Ereignisse.
Therapien, die das Fortschreiten kardiovaskulärer Erkrankungen aufhalten, reduzieren auch die Rate an plötzlichem Herztod, aber sie tragen nicht zur Behandlung von solchen Rhythmus-Ereignissen bei.
ICDs behandeln effektiv ventrikuläre Rhythmus-Ereignisse und verhindern, sofern es sich und transvenöse Systeme handelt, auch Bradykardien.
Antiarrhythmische Medikamente reduzieren ebenfalls die Rate an plötzlichem Herztoden, aber sie können die Gesamtmortalität nicht verbessern.
Sekundäre Prävention
ICDs reduzieren die Mortalität bei Patienten mit überlebtem plötzlichen Herztod oder ventrikulären Rhythmusstörungen, im Gegensatz zu Amiodaron.
Ein ICD wird zur Sekundärprävention nur empfohlen, wenn die Verlängerung des Lebens beabsichtigt ist. Dementsprechend sollten der Wille des Patienten, seine Lebensqualität und andere Erkrankungen, die zu einer Lebenserwartung unter einem Jahr führen, berücksichtigt werden.
Bei einer EF über 35% ist der Überlebensvorteil nicht gesichert.
Die Leitlinien empfehlen die Sekundärprophylaxe mit ICD nach einer ventrikulären Arrhythmie, die zur hämodynamischen Instabilität führte und die keine reversible Ursache hatte, insbesondere nicht innerhalb von 48h nach einem Myokardinfarkt aufgetreten ist (Klasse I, Grad A).
Primäre Prävention
In einer Studienanalyse konnte nachgewiesen werden, dass die Rate an plötzlichem Herztod in den letzten 20 Jahren um 44% gesenkt werden konnte. Die Ursachen sind die Verbesserung der Herzinsuffizienztherapie mit Betablocker, Aldosteronantagonisten, Sacubitril/Valsartan und CRT-Schrittmachern.
Amiodaron verbessert die Mortalität bei Patienten mit HFrEF nicht. Auch Dronedaron und Klasse-I-Antiarrhythmika wie Flecainid sollten nicht zur Prophylaxe von ventrikulären Rhythmusstörungen verwendet werden, da sie in klinischen Studien die Mortalität erhöhen.
In der DANISH-Studie waren die Raten an plötzlichem Herztod mit nicht-ischämischer Kardiomyopathie gering. Dementsprechend konnte durch einen Defibrillator keine signifikante Reduktion der Mortalität erreicht werden. Subgruppen-Analysen zeigte aber einen Benefit bei Patienten bis 70 Jahre. In einer aktuellen Metaanalyse war eine leichte Mortalitätsreduktion nachweisbar.
Patienten mit ischämischer Kardiomyopathie haben ein höheres Risiko für einen plötzlichen Herztod als Patienten mit nicht-ischämischer Kardiomyopathie, entsprechend ist auch der Nutzen eines Defibrillators höher.
Zwei Studien zeigten keinen Nutzen, wenn der Defibrillator in den ersten 40 Tagen nach Infarkt implantiert wird. Für diesen Zeitraum ist die Defi-Implantation kontraindiziert (Klasse III, Grad A). Mindestens 3 Monate sollte versucht werden, durch optimale medikamentöse Therapie, die EF über 35 anzuheben.
Für Patienten mit einer EF über 35 gibt es keine gesicherte Daten. Derzeit läuft eine Studie zum Nutzen eines ICDs bei Patienten mit einer Narbe und einer EF über 35%.
Eine Indikation für eine Primärprophylaxe mit einem ICD haben Patienten mit Herzinsuffizienz der NYHA-Klassen II und III, die trotz mindestens 3 monatiger optimaler medikamentöser Therapie eine EF nicht über 35 %, grundsätzlich eine Lebenserwartung über 1 Jahr und einen ordentlichen funktionellen Status haben. Bei ischämischer Kardiomyopathie besteht Empfehlungsklasse I, bei nicht ischämischer Kardiomyopathie Empfehlungsklasse IIa, jeweils bei Evidenzlevel A.
Patientenselektion
Patienten mit NYHA-IV-Herzinsuffizienz trotz optimaler Therapie profitieren nicht von einer ICD-Implantation, da die Mortalität durch Herzversagen, das nicht mit plötzlichem Herztod zusammenhängt, stark zunimmt (Klasse III, Grad C). Eine Ausnahme ist, wenn die Patienten auf ein CRT, ein VAD oder eine Transplantation warten.
Bei Patienten mit nicht-ischämischer Kardiomyopathie sollte bezüglich der Indikation für ein ICD auf die Ätiologie und auf die Narbenausdehnung im MRT. Zum Beispiel ist bekannt, dass Sarkoidose ein besonders hohes Risiko im Vergleich zu anderen nicht-ischämischen Kardiomyopathien hat.
Patienten sollten bezüglich des Nutzens eines Defi aufgeklärt werden. Sie sollten in den Entscheidungsprozess stets einbezogen werden. Sie sollten über OP-Komplikationen, unangemessene Schockabgaben, Auswirkungen auf die Fahrtüchtigkeit, Möglichkeit der Deaktivierung und Notwendigkeit der Explantation bei Infekten oder bei Erholung der LV-Funktion aufgeklärt werden (Klasse IIa, Grad B).
Wenn die ICD-Batterie am Ende ist, sollte nicht automatisch ein Ersatz erfolgen. Vielmehr ist die Indikation erneut zu überprüfen. Dabei ist zu evaluieren, ob das Risiko für plötzlichen Herztod abgenommen hat, oder andere Risiken diesem Risiko nun überwiegen (Klasse IIa, B).
Programmierung
Die ICD-Programmierung erfolgt konservativ, mit langer Latenz zwischen Detektion und Schockauslösung. Es wird so programmiert, dass minimal stimuliert (VVI bei 40/min) und defibriliert (>200/min) wird.
Subkutane ICDSs und Life-West
Subkutane ICDs sind nicht weniger effektiv als herkömmliche und haben eine ähnliche Komplikationsrate (z.B. unangemessene Schockabgaben). Mögliche Indikationen sind schwierige Venenverhältnisse und Sonden-Endokarditis.
Sie haben aber keine Pacer-Möglichkeit, können daher weder im Rahmen von Bradykardien, noch zum anti-tachykarden Pacing oder in Zusammenhang mit einem CRT-Device eingesetzt werden. Studien zur Sicherheit und Effizienz sind im Gange.
Tragbare Defibrillatoren können erwogen werden für eine eingeschränkte Zeitdauer bei Hoch-Risiko-Patienten, als Überbrückung bis zur ICD-Implantation (Klasse IIb, Grad B). In der VEST-Studie konnte nicht nachgewiesen werden, dass bei Herzinfarktpatienten mit einer EF unter 35% die Mortalitäts-Rate für den arrhythmogenen Herztod gesenkt werden kann.